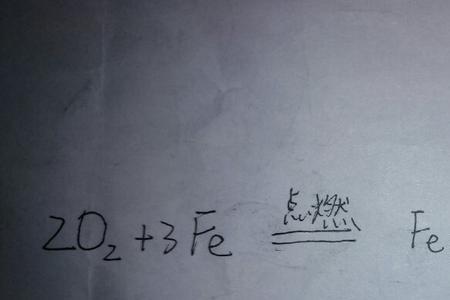硫酸根离子的空间构型是正四面体形。按中心原子价层电子对理论,中心原子为S,在硫酸根离子中,价层电子为,6(硫原子最外层电子数)十2(阴离子所带负电荷数)=8,价层电子对数为,8÷2=4。所以呈正四面体形。根据等电子体理论,PO43一,SiO42一也为正四面体形。
硫酸根的空间构型是什么
理化性质
【离子结构】硫酸根是一个硫原子和四个氧原子通过共价键连接形成的四面体结构,硫原子以sp3杂化轨道成键,硫原子位于四面体的中心位置上,而四个氧原子则位于它的四个顶点,一组S-O-S键的键角为109°28',S-O键的键长为1.49pm。因硫酸根得到两个电子才形成稳定的结构,因此带负电,且很容易与金属离子或铵根结合,产生离子键而稳定下来。
硫酸根离子的结构说法不一。根据高等教育出版社出版的《无机化学》(第四版)下册p503-505,“SO₄²⁻离子呈正四面体结构,其中S-O键键长为149pm,有很大程度的双键性质。4个氧原子与硫原子之间的键完全一样。”
硫酸根遇高温会分解为二氧化硫和氧。因此煤在燃烧前都要经过总硫含量测定,以减少有害气体的排放。
一般硫酸盐都易溶于水。硫酸银略溶,碱土金属(除Be、Mg外)和铅的硫酸盐微溶。可溶性硫酸盐从溶液中析出的晶体常常带有结晶水如CuSO₄·5H₂O、FeSO₄·7H₂O等。除碱金属和碱土金属外,其他硫酸盐都有不同程度的水解作用。
1
生成过程
1、在水中溶解的硫酸根离子是由于硫酸或可溶性硫酸盐溶于水产生的。硫酸为强电解质,溶于水会迅速发生二级电离,产生两个氢离子和一个硫酸根离子(中学阶段按照教科书描述可以这么认为,但是事实上其第二次电离约为10%左右)。
2、亚硫酸根离子被氧化或三氧化硫溶于水也会产生硫酸根。
3、含硫氨基酸经过氧化分解也会生成硫酸根,且半胱氨酸代谢是人体内硫酸根的主要来源。
检验
国内外检测硫酸根含量的方法很多,主要有重量法、滴定法、分光光度法、离子色谱法(IC法)、浊度计法、原子吸收法(AAS)、ICP-AES法等。其中,重量法、IC法、浊度计法是检测油田水中硫酸根含量推荐的三种方法滴定法、分光光度法在油田上的应用较为广泛光谱法是新型的检测方法。
硫酸根与金属钡离子结合会产生硫酸钡白色沉淀,但有许多不溶性钡盐也为白色,但它们多溶于酸,而硫酸钡不溶于酸。因此检验硫酸根离子时,通常先使用盐酸使实验环境酸化,排除碳酸根的干扰,然后加入可溶钡盐,如氯化钡,以此确定液体是否含有硫酸根离子。同时要注意到:必须先加入盐酸,后加入氯化钡,否则易受银离子干扰,产生白色沉淀,影响检验。所以应当:
(1)加入盐酸,然后滤去沉淀
(2)加入氯化钡,观
硫酸根
察是否有白色沉淀。
检验时加入的钡盐最好是氯化钡,硝酸钡不好,因为氢离子与硝酸根离子相遇时会有强氧化性,会使亚硫酸盐氧化为硫酸盐,无法检验原溶液中是否有硫酸盐。但要将生成的白色沉淀中滴加稀硝酸,若白色沉淀不溶解,则更能说明含硫酸根离子。
推荐的离子方程式:
Ba2⁺ + SO₄ = BaSO₄↓
Ba + CO₃ = BaCO₃↓,但是因为 CO₃ + 2H⁺ = H₂O+CO₂↑,所以可以用酸环境排除碳酸根干扰。
硫酸根的空间构型是什么
硫酸根,也可称为硫酸根离子,S原子采用sp3杂化,离子呈正四面体结构,硫原子位于正四面体体心,4个氧原子位于正四面体四个顶点。有很大程度的双键性质。4个氧原子与硫原子之间的键完全一样。存在于硫酸水溶液,硫酸盐、硫酸氢盐等的固体及水溶液中